Введение
Хроническая воспалительная демиелинизирующая полинейропатия (CIDP) — это приобретенное демиелинизирующее заболевание, поражающее периферические нервы, и обычно считается хроническим аналогом синдрома Гийена-Барре (GBS). Около 16% пациентов представляют начальную форму острого GBS.
Пациенты обычно представляют постепенную и затяжную (>2 месяца) симметричную слабость, проблемы с равновесием, ухудшенную чувствительность и сниженные рефлексы и сенсорные изменения.
- Длительный характер этого состояния приводит к нарушениям походки и ухудшению как психологического, так и социального функционирования.
- Прогноз варьируется и зависит от возраста, клинического течения, реакции на лечение и электрофизиологических показателей. [1][2] [3][4]
Это полезное видео на 3,5 минуты.
Патофизиология
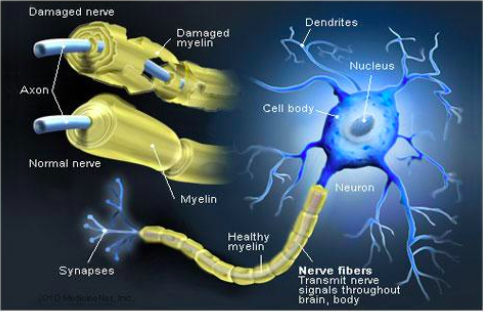
Хроническая воспалительная демиелинизирующая полинейропатия — это приобретенное демиелинизирующее заболевание периферической нервной системы.
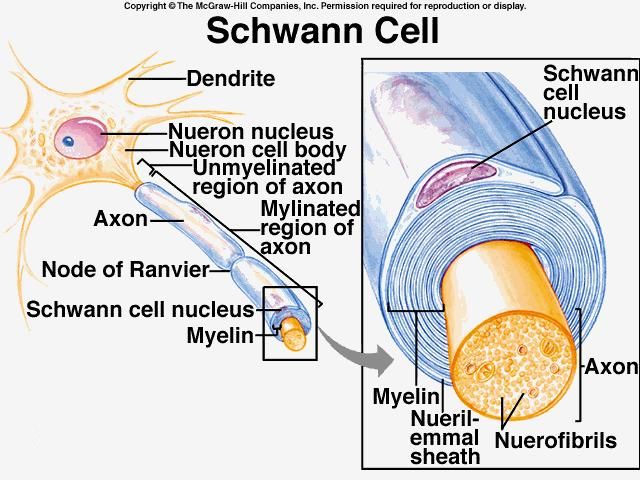
Вокруг периферических нервов находится белый жировой слой миелина, состоящий из глиальных клеток, называемых клетками Швана. Миелиновое покрытие, создаваемое клетками Швана, помогает аксонам передавать быстрее нервные импульсы к рецепторным участкам, таким как органы и мышцы.
- При CIDP этот миелин вокруг нервов разрушается, что приводит к изменениям денервации в снабжаемых мышцах.
- Пораженные нервы демонстрируют сегментарную инфильтрацию воспалительными клетками (лимфоцитами) и демиелинизацией.
- С течением времени происходит пролиферация клеток Швана и отложение коллагена, что вызывает утолщение нерва и характерный вид луковицы. [1][7]
Этиология
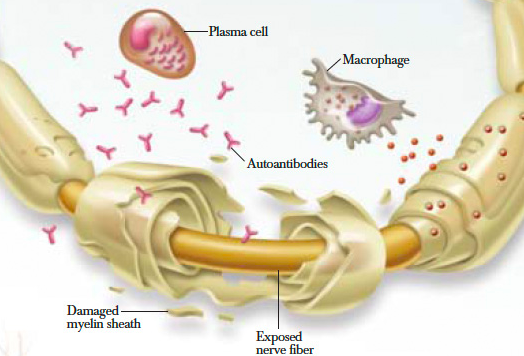
CIDP — это аутоиммунное расстройство.
- Она включает как Т-клеточный-опосредованный, так и гуморальный иммунные механизмы, направленные на миелин периферической нервной системы.
- Классическая CIDP идиопатична, но имеет варианты, которые могут быть связаны с неопластическим процессом, инфекцией ВИЧ, и хронической историей сахарного диабета II типа.[4]
Эпидемиология
Общая распространенность оценивается около 0,8 до 8,9 на 100 000 и увеличивается с возрастом (пиковая частота в возрасте от 40 до 60 лет). CIDP преимущественно поражает мужчин больше, чем женщин, с соотношением 2:1. CIDP предполагается сильно недооцененной, частично из-за недоучета, неопределенности в диагностике и несоответствия диагностических критериев.[4] [3]
Клиническая картина
Лица часто сообщают о трудностях с ходьбой, подъемом по лестнице, балансом и ручной ловкостью, что связано с прогрессирующей, симметричной слабостью конечностей и потерей чувствительности. Обычно наблюдается поражение проксимальных мышц на ранних стадиях, затем постепенно переходящее на дистальные конечности. Онемение, покалывание и жужжание могут быть характерными для потери чувствительности, о которой сообщают пациенты, и невропатическая боль реже сообщается[8].
С другой стороны, у некоторых людей эти симптомы могут отсутствовать, что делает диагностику намного сложнее и может занять много лет, оставляя пациентов без ответов и с возрастающим разочарованием[9].
После полной субъективной и объективной истории, в дополнение к дальнейшим медицинским расследованиям, которые могут занять несколько месяцев после начала симптомов, были выделены следующие основные кардинальные особенности CIDP[10]:
- Прогрессирование как минимум в течение 2 месяцев
- Преобладание моторных симптомов
- Симметричное поражение рук и ног
- Поражение проксимальных мышц вместе с дистальными мышцами
- Снижение или отсутствие глубоких сухожильных рефлексов
- Повышение белков в спинномозговой жидкости (CSF) без плеоцитоза
- Доказательства нервной проводимости первичной демиелинизирующей невропатии
Дифференциальная диагностика
Дифференциальные диагнозы включают:[11][12]
- Синдром Гийена-Барре (СГБ): острое проявление ХИДП может быть схожим; сложно различить в первые 6 недель; через 6-8 недель СГБ должно улучшаться, в то время как ХИДП будет проявлять хроническое воспаление. [1]
- Мультфокальная моторная невропатия
- Диабетическая полиневропатия
- Фибромиалгия
- Рассеянный склероз
- Амиотрофический латеральный склероз (АЛС)
- Невропатии, связанные с: дефицитом питательных веществ, критическими состояниями, токсинами, системными воспалительными заболеваниями.
Диагностика
Диагностика и лечение ХИДП являются сложными задачами и требуют командной работы межпрофессиональной команды как стационарного, так и амбулаторного звена. Команда включает общего невролога, специалиста по заболеваниям нервно-мышечной системы, интенсивную терапию, специалиста по физической и реабилитационной медицине, специалиста по управлению болью, физиотерапевта, эрготерапевта, психиатра, социальных работников и персонал по управлению случаями [4]
Нередко ХИДП остается недиагностированным в течение месяцев или даже лет в зависимости от симптомов пациента. Это может быть связано с тем, что симптомы не достаточно выражены, чтобы влиять на повседневную жизнь и заставлять пациента обращаться к врачу. Кроме того, наличие негрубияноклинических симптомов затрудняет определение точного диагноза ХИДП на начальных стадиях, даже после консультации у врача[9].
Управление/Интервенции
Варианты лечения ХИДП включают кортикостероиды, внутривенные иммуноглобулины (IVIG) и плазмаферез (PLEX). Кортикостероиды используются в качестве промежуточной терапии из-за долгосрочных побочных эффектов. Последовательные IVIG и плазмаферез являются основой терапии. Пациенты, реагирующие на лечение, должны продолжать его до тех пор, пока их состояние не стабилизируется или не наступит максимальное улучшение. Улучшения измеряются по сопоставимым признакам, таким как улучшение ощущения, силы и выполнения повседневной деятельности (АДЛ). Дальнейшее лечение/поддерживающая терапия предоставляется для оказания помощи человеку с намерением уменьшить частоту рецидивов и замедлить прогрессирование заболевания. Цели лечения также направлены на уменьшение симптомов пациента, таких как слабость и боль, и улучшение общей функциональности. [4][12][8].
Эрготерапевты или физиотерапевты могут назначать методы помощи при ходьбе, специализированные инструменты и голеностопно-стопные ортезы, если это необходимо, чтобы помочь людям с функциональными инструментами для выполнения АДЛ и передвижения.
Психологи также могут быть важной частью межпрофессиональной команды, так как они могут устранять симптомы, часто сопутствующие диагнозу хронического заболевания и изменению функционального состояния, такие как депрессия, тревожность или раздражение[8].
Следующее описание процесса выбора медицинского управления, предложенное Валла.
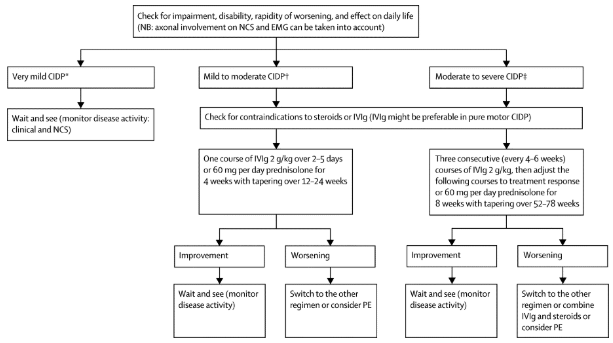
Физиотерапевтическое лечение
Роль физиотерапевта в лечении ЦИДП должна быть очень специализированной для каждого пациента. Физиотерапевты назначают вспомогательные средства для ходьбы, которые могут помочь с балансом и передвижением в повседневной жизни. Ручная терапия также может быть предоставлена при необходимости для предотвращения контрактур суставов и сохранения доступного объема движений. Поскольку многие люди с ЦИДП испытывают трудности с балансом и ходьбой, программы переобучения ходьбе и терапевтических упражнений оказывают благоприятное влияние на повышение эффективности и выносливости[8].
Упражнения, способствующие укреплению мышц и аэробной кондиции, важны после того, как пациенты получили разрешение от врача на выполнение упражнений[16]. Параметры упражнений для пациентов с ЦИДП также должны быть индивидуально подобраны, так как важно, чтобы они не перенапрягались. Из-за демиелинизации аксонов организм не может задействовать столько мышечных волокон для выполнения задачи, что может привести к перенапряжению задействованных мышечных волокон. Ожидается, что некоторая задержка в начале болевого синдрома мышц будет присутствовать, но боль, сохраняющаяся более 12-48 часов, с потерей силы или без нее, указывает на то, что параметры F.I.T.T. необходимо скорректировать, так как пациент перенапрягся[16]. Также важно оценить, могут ли пациенты с ЦИДП выполнять движения против силы тяжести, прежде чем применять внешнее сопротивление к движению, так как важно иметь базовый контроль мышц перед прогрессом в упражнениях[16].
Недавние исследования о влиянии программ упражнений на пациентов с ЦИДП предоставили хорошее представление и направление для будущих физиотерапевтических процедур. Янссен и соавт., (2018)[2] закончили вмешательство, разработанное на основе программы упражнений Otago на дому. Этот протокол был нацелен на предотвращение падений, упражнения для нижних конечностей и укрепления кора с динамическим переобучением баланса. Их цель состояла в максимизации ходьбы и функциональных движений, необходимых для поддержания и восстановления. Пациентам была назначена индивидуальная программа упражнений для выполнения три раза, а также 30-минутная ходьба дважды в неделю в течение 6 недель. Физиотерапевт мог проверять участников в течение 6 недель. Результаты продемонстрировали, что индивидуализированная программа упражнений оказала положительное влияние на скорость ходьбы и баланс у пациентов с ЦИДП. Более подробные исследования потребуются для полной оценки долгосрочного воздействия, однако это очень положительные результаты и должны учитываться при лечении пациента с ЦИДП[2].

Марквандсен и др., (2017)[18] изучили воздействие программ тренировок аэробных или силовых упражнений в течение 12 недель. Программа аэробных упражнений включала использование эргометрического велосипеда дома или в местном фитнес-центре в течение 20-30 минут 3 раза в неделю. Программа силовых упражнений, которая тренировала флексоры/экстензоры колена и локтя на более слабой стороне пациента, выполнялась 3 раза в неделю под наблюдением авторов, и каждое упражнение выполнялось 12 раз в трех подходах.
В течение периода аэробных тренировок показатели VO2 max, результаты 6MWT и сила мышц увеличивались. Силовые тренировки также привели к увеличению силы мышц на тренировавшейся, изначально более слабой, стороне. Результаты исследования показывают, что тренировочные физические упражнения для пациентов с ЦИДП выполнимы и эффективны. Их исследование показало, что не произошло изменений в инвалидности, качестве жизни и степени утомляемости. Авторы предположили, что отсутствие изменений в качестве жизни было связано с трудностью выполнения упражнений 3 раза в неделю и истощением после упражнений[18]. Это должно быть учтено при разработке программы упражнений для пациента с ЦИДП.
Прогноз
Прогноз при ЦИДП сильно зависит от возраста на момент начала заболевания, клинической формы болезни и первоначальной реакции на лечение[13]. Хотя это еще не подтверждено, предполагается, что увеличение времени между началом симптомов и началом лечения приведет к плохому прогнозу[13]. Для двух третей людей, у которых был диагностирован ЦИДП, их болезнь прогрессирует, а оставшаяся треть имеет рецидивирующие эпизоды[8]. Прогноз благоприятный для пациентов с монопазным или рецидивирующим течением ЦИДП, и молодые пациенты с быстрым началом или монопазным течением более вероятно ответят на лечение[13]. Долгосрочные ремиссии после лечения менее часты у пожилых людей по сравнению с юношами или взрослыми младше 64 лет[13].
Измерения результатов
Следующие измерения результатов были подтверждены для использования у людей с ЦИДП:
- Тест "Встать и идти" (TUG) → Время, необходимое для того, чтобы встать с кресла, пройти небольшое расстояние, развернуться, вернуться и снова сесть
- Тест ходьбы на 10 метров (10MWT) → скорость ходьбы
- Сила хвата
- Тестирование мышечной силы вручную и тестирование изокинетической силы → тестирование мышечной силы
- Шкала степени утомляемости (FSS) → измеряет утомляемость
- SF-36 → измерение качества жизни; физическое функционирование, функциональная роль, социальное функционирование, боль в теле, психическое здоровье, жизненная сила, общее восприятие здоровья и изменения в здоровье
- Шкала равновесия Берга → измеряет равновесие при выполнении функциональных задач
- Визуальная аналоговая шкала (VAS)
- Тест шестиминутной ходьбы (6MWT) → скорость ходьбы[2][18][19]
Литература
- ↑ 1.0 1.1 1.2 Radiopedia Хроническая воспалительная демиелинизирующая полиневропатия Доступно:https://radiopaedia.org/articles/chronic-inflammatory-demyelinating-polyneuropathy (по состоянию на 23.9.2022)
- ↑ 2.0 2.1 2.2 2.3 Janssen J, Bunce M, Nixon J, Dunbar M, Jones S, Benstead J и др. Клиническая серия случаев, исследующих эффективность упражнения при хронической воспалительной демиелинизирующей полиневропатии. Physiotherapy Practice and Research. 2018;39(1):37-44
- ↑ 3.0 3.1 Latov N. Диагностика ХВДП. Неврология. 2002;59(6):S2-S6.
- ↑ 4.0 4.1 4.2 4.3 4.4 Gogia B, Rai PK. Хроническая воспалительная демиелинизирующая полирадикулоневропатия. Доступно:https://www.statpearls.com/ArticleLibrary/viewarticle/119994 (по состоянию на 23.9.2022)
- ↑ GBS-CIDP Foundation International. Хроническая Воспалительная Демиелинизирующая Полиневропатия (ХВДП) 101. Доступно по адресу:https://www.youtube.com/watch?v=WJVVYk1sg0I [последний доступ 23.9.2022]
- ↑ Цель клеток Шванна. (2018). [изображение] Доступно на: https://socratic.org/questions/in-human-anatomy-what-is-the-purpose-of-the-schwann-cells [Доступ 7 мая 2018].
- ↑ Blumenfeld H. Нейроанатомия через клинические случаи. 2-е изд. Сандерленд, Массачусетс: Sinauer Associates, Inc.; 2010
- ↑ 8.0 8.1 8.2 8.3 8.4 Gorson K. Обновление сведений по лечению хронической воспалительной демиелинизирующей полиневропатии. Therapeutic Advances in Neurological Disorders. 2012;5(6):359-373
- ↑ 9.0 9.1 Wolfe, G. и Greer, M. (2015). Диагностика и лечение ХВДП - GBS/CIDP Foundation International. [онлайн] GBS/CIDP Foundation International. Доступно на: https://www.gbs-cidp.org/ecomm/diagnosing-and-treating-cidp/ [Доступ 7 мая 2018].
- ↑ Lewis R. Хроническая воспалительная демиелинизирующая полиневропатия. Current Opinion in Neurology. 2017;30(5):508-512
- ↑ Lewis R. Хроническая Воспалительная Демиелинизирующая Полиневропатия. Neurol Clin. 2007;25(1):71-87. doi:10.1016/j.ncl.2006.11.003.
- ↑ 12.0 12.1 Koller H, Kieseier B, Jander S, Hartung H. Хроническая Воспалительная Демиелинизирующая Полиневропатия. The New England Journal of Medicine. 2005;352:1343-1356
- ↑ 13.0 13.1 13.2 13.3 13.4 Vallat J-M, Sommer C, Magy L. Хроническая воспалительная демиелинизирующая полирадикулоневропатия: диагностические и терапевтические проблемы для лечимого состояния. The Lancet Neurology. 2010;9(4):402–12
- ↑ Vallat J-M, Sommer C, Magy L. Хроническая воспалительная демиелинизирующая полирадикулоневропатия: диагностические и терапевтические проблемы для лечимого состояния. The Lancet Neurology. 2010;9(4):402–12
- ↑ Мануальная терапия – Foul Bay Physio [Интернет]. Foulbayphysio.com. 2018 [цитируется 7 мая 2018]. Доступно по адресу: http://www.foulbayphysio.com/service/manual-therapy/
- ↑ 16.0 16.1 16.2 Hansen M. Упражнения для ХВДП. 2010
- ↑ SCIFIT Верхний Измеритель Тела - Аренда Фитнес Оборудования [Интернет]. Rent Fitness Equipment. 2018 [цитируется 7 мая 2018]. Доступно по адресу: https://rentfitnessequipment.com/catalogue/scifit-upper-body-ergometer/
- ↑ 18.0 18.1 18.2 Markvardsen L, Overgaard K, Heje K, Sindrup S, Christiansen I, Vissing J и др. Силовые тренировки и аэробные тренировки улучшают мышечную силу и аэробную способность при хронической воспалительной демиелинизирующей полиневропатии. Muscle & Nerve. 2017;57(1):70-76
- ↑ Allan J, Gelinas D, Lewis R, Nowak R, Wolfe G. Оптимизация использования методов оценки при хронической воспалительной демиелинизирующей полиневропатии. US Neurology. 2018;13(1):26-34