Области мозга в нейроматрице и изменения из-за хронической боли
Исследования с использованием функциональной МРТ выявили шесть общих областей, активируемых при острой боли. Эти области включают первичную соматосенсорную кору (S1), вторичную соматосенсорную кору (S2), переднюю часть поясной коры, островковую кору, префронтальную кору и таламус. Именно эти области образуют нейроматрицу боли, которую определил Мелзак[1]. Больше информации о теории нейроматрицы боли и модели зрелого организма можно найти на странице Многомерная природа боли и на сайте Луи Гиффорда здесь.
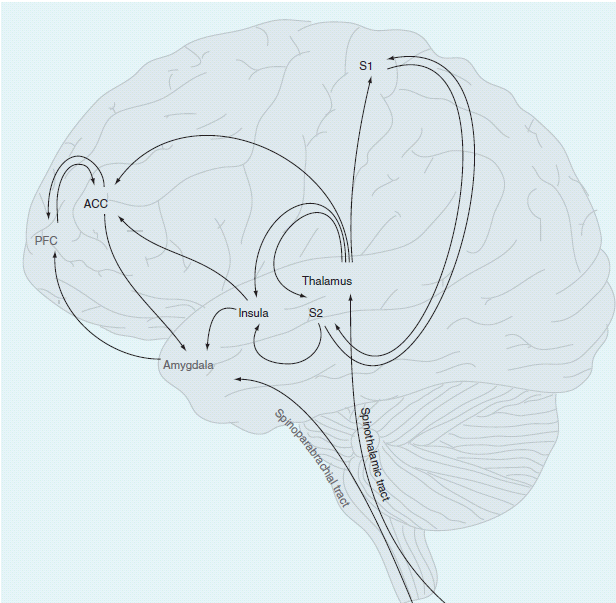
В обзоре, проведенном Lithwick и др. (2013), роль этих областей в производстве боли объясняется подробно.[2] Первичная соматосенсорная кора отвечает за сенсорную дискриминацию, определяя, откуда поступают сигналы о боли. У пациентов с хронической болью наблюдалась более широкая контралатеральная активация по сравнению с острой болью, где активировалась только ипсилатеральная сторона. Другое исследование обнаружило, что у людей с хронической болью существует небольшая корковая репрезентация S1 и это подразумевает, что «имеется диссоциация между активацией первичных сенсорных областей и фактическим источником боли.»[2] Эти изменения в активации первичной соматосенсорной коры можно использовать для объяснения того, почему пациенты с хронической болью более склонны чувствовать более диффузную боль и часто не могут точно локализовать свою боль, так как у этих пациентов значительно больше активации первичных сенсорных областей. Это также может объяснить, почему боль у пациента может начинаться в колене, а затем начинается воздействие на бедро, так как активируются более значительные области первичной соматосенсорной коры.
Вторичная соматосенсорная кора (S2)
Она связана с различением интенсивности боли. Было показано, что имеется ко-активация первичной соматосенсорной коры и вторичной соматосенсорной коры. У пациентов с хронической болью наблюдается «двусторонняя активация, по сравнению с контралатеральной активацией, наблюдаемой при острой боли.» Это указывает на то, что имеется меньшее представление начальной боли и вновь может способствовать широко распространенной, неясной боли, описываемой пациентами с хронической болью.
Передняя часть поясной коры (ACC)
Передняя часть поясной коры (ACC) ассоциируется с эмоциональными и когнитивно-оценочными аспектами обработки боли наряду с сенсорными восприятиями из-за их перекрытия с S1. У пациентов с хронической болью наблюдается двусторонняя и более широкая активация ACC по сравнению с острой болью.[3] Авторы сделали вывод, что это указывает на обостренное чувство боли у пациентов с хронической болью, а также на сдвиг в сторону более эмоционального аспекта в хронической боли. Хотя всегда имеется эмоциональный аспект боли, эти авторы сделали вывод, что из-за увеличенной активации ACC, наблюдаемой при хронической боли, эмоциональный аспект оказывает большее воздействие на производство боли и может способствовать продолжающимся высоким уровням боли.
Островковая кора
Островковая кора (ОК) играет роль как в сенсорном, так и в аффективном восприятии боли – в аспекте страдания от боли. Она часто коактивируется с передней частью поясной коры. При хронической боли наблюдается более распространенная активация ОК по сравнению с острой болью. ОК также более связана с сенсорной дискриминацией при хронической боли, а не с эмоциональной обработкой. Роль ОК в страдании «минимизируется, чтобы разместить огромное увеличение активации, наблюдаемое в S1 и S2.»[2] Из-за увеличенной активации S1 и S2 в ОК увеличивается активация, но более направлена на сенсорное восприятие для обработки увеличенного объема информации из периферии. Это изменение способствует аллодинии и гипералгезии, наблюдаемым при хронической боли.
Префронтальная кора
Префронтальная кора отвечает за когнитивную оценку боли. Три области связаны с болью: медиальная префронтальная кора (mPFC), дорсолатеральная префронтальная кора (DLPFC) и орбитофронтальная кора. mPFC представляет аффективный аспект боли, DLPFC участвует в локализации болевых стимулов, а орбитофронтальная кора связывает дискриминацию болезненной области, память и эмоции. Литвик (2013) отметил, что у людей с хронической болью в спине mPFC находилась в значительном гиперактивном состоянии, что может снижать активность мозга в других областях в целом, влияя на способность мозга выполнять другие задачи.[2] В целом изменение в PFC из-за хронической боли представляет собой сдвиг в сторону увеличенной эмоциональной обработки.
В итоге исследования показывают, что у пациентов с хронической болью наблюдается более широкая активация областей, связанных с восприятием и производством боли. Это может объяснить неясную, распространенную природу хронической боли. Также наблюдается большая активация областей мозга, связанных с эмоциональной обработкой при хронических болевых состояниях. Это может объяснить некоторые из эмоциональных изменений, которые могут происходить при хронических болевых состояниях. Психологические основы боли предоставляет больше информации о некоторых изменениях, которые могут происходить при хронической боли.
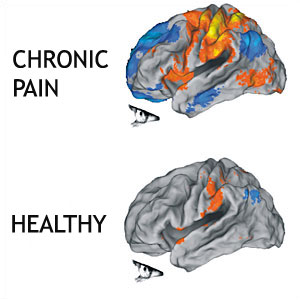
Не только разные части мозга активируются, когда боль становится хронической, но также может происходить «размывание» сенсорной и моторной гомункулюсов мозга. «Размывание» относится к изменениям в областях мозга, преданных обнаружению стимуляции частей тела и выполнению функций, начинают пересекаться. Этот процесс объясняет, почему некоторые части тела могут становиться труднее использовать, тогда как другие области становятся более чувствительными по сравнению с травмированной областью. Больше информации об этом можно найти на странице центральная сенситизация. Флор (2003) выдвинул гипотезу, что эта общая широкая активация и расширение зоны представления может привести к возникновению болевых ощущений в отсутствие периферической стимуляции.[4]
Эти изменения в анатомии мозга являются результатом увеличенного ноцицептивного входа из периферии, который приводит к системным и анатомическим изменениям, обсуждаемым выше. Wand и др. (2011) делают вывод, что «вероятно, что часть болевого опыта пациентов с хронической болью в пояснице осуществляется за счет изменений чувствительности в центральной нервной системе, и продемонстрированные изменения в мозге вероятно способствуют этому." Совпадающая информация достигает коры через множество путей в спинном мозге. Модуляция этих корковых областей происходит из-за постоянных волн ноцицептивных входов, ассоциированных с хронической болью.
В исследовании, проведенном Seminowicz и др. в 2011 году, изучали эффект хронической боли на анатомию мозга и могут ли эффективное лечение обратить эти изменения. Они обнаружили, что у пациентов с хронической болью наблюдается уменьшение толщины коры в DLPFC, передней части островковой коры, передней части поясной коры и первичной соматосенсорной коре.[6] Утрата толщины коры соответствует утрате нейронов и замедлению скорости синапсов. Затем они лечили боль пациента блокадой нервного корешка или спинальной хирургией, чтобы определить, стала ли данная корковая область снова утолщенной с уменьшением боли. Единственное статистически значимое обнаружение - это увеличение толщины DLPFC у пациентов, которые сообщили о снижении интенсивности боли и улучшении физических нарушений. Авторы сделали вывод, что требуется больше исследований, чтобы определить, приведут ли вмешательства, направленные на психосоциальные, а не биомеханические компоненты хронической боли, к аналогичному восстановлению толщины коры.
Эффекты хронической боли на когнитивные функции и рабочую память
Рабочая память относится к системе краткосрочного удержания информации, которая является необходимой для навыка сохранения и манипулирования поведенчески значимой информацией.[8] Эффективная функция рабочей памяти необходима для руководства поведением, принятия решений и планирования. Пациенты с хронической болью часто демонстрируют когнитивные или рабочие дефициты памяти и часто испытывают затруднения при выполнении когнитивно сложных задач.[9]
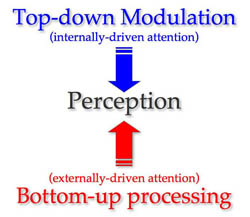
Легрен и др. (2009) разработали нейрокогнитивную модель внимания к боли, которая призвана объяснить эти изменения у пациентов с хронической болью. Они объясняют режимы выбора внимания: захват внимания снизу-вверх и модуляцию внимания сверху-вниз.[10] Захват внимания снизу-вверх очевиден в ситуации, когда вы кладете руку на плиту во время готовки. Сообщение о боли прерывает любые другие сообщения, идущие в мозг или из него, чтобы гарантировать, что вы быстро уберете свою руку, прежде чем нанести больший ущерб. Непроизвольный захват боли — это самая важная функция системы болевой тревоги, чтобы прекратить выполнение других действий и сосредоточиться на сообщениях о боли и расставить приоритеты для предотвращения травм. Легрен и др. (2009) сообщают, что исследования показали: внимание невольно захватывается, если боль интенсивная, новая и угрожающая, и это проявляется в худшем выполнении задач во время боли. Таким образом, для кого-то, страдающего хронической болью, постоянный поток сообщений о боли из периферии, вероятно, будет препятствовать выполнению других задач из-за этого прерывания внимания.
Легрен и др. (2009) затем объясняют, как модуляция внимания сверху-вниз может уменьшить или модулировать реакцию на боль. «Многочисленные исследования показали снижение боли, когда внимание направлено от ноцицептивных стимулов.»[10] Нейровизуализационные исследования показали, что реакции на болезненные стимулы в мозге уменьшаются, когда внимание сильно сосредоточено на основной визуальной задаче. Однако модуляция сверху-вниз также может усилить внимание пациента или концентрацию на болезненном стимуле. Внимание может легче захватываться болью, если болезненный стимул происходит в части тела, которая участвует в задаче. Например, если у пациента болит рука, когда его попросили писать или рисовать, пациент сообщит об увеличении интенсивности боли. Легрен и др. (2009) заключают, что при хронической боли, вероятно, существует тенденция к увеличению внимания или концентрации на информации, связанной с болью, и снижению способности уменьшать боль с помощью модуляции сверху-вниз из-за ожиданий болезненности стимула или активности. Однако использование модуляции внимания сверху-вниз, возможно, посредством медитации или отвлечения, может на самом деле помочь уменьшить боль.
Было проведено множество исследований, которые пытались понять, как повышенное внимание к боли может привести к снижению рабочей памяти. Уолтерос и др. (2011) сравнили пятнадцать пациентов с фибромиалгией и пятнадцать здоровых пациентов и оценили их выполнение задач Iowa Gambling Task и conditional associative learning task. Результаты показали, что пациенты с фибромиалгией имели более худшие результаты, чем здоровые контрольные группы в обеих задачах. Пациенты с фибромиалгией совершали больше ошибок в задаче на обучение и принимали более невыгодные решения в задаче на азартные игры.[9]
Берриман и др. (2013) провели систематический обзор, чтобы определить, является ли хроническая боль причиной нарушений в рабочей памяти. Они критически оценили двадцать четыре исследования, в том числе исследование, проведенное Уолтерос и др. (2011). Они обнаружили, что в исследованиях, которые использовали поведенческие показатели, хроническая боль была связана с уменьшением вербальной рабочей памяти, снижением невербальной памяти, снижением внимания, снижением слухового контроля и снижением визуальной памяти. Однако результаты исследований ЭЭГ и функциональной МРТ не отражали результаты поведенческих исследований. Не наблюдалось различий между пациентами с хронической болью и здоровыми контрольными группами при исследовании латентности или амплитуды.[8]
Авторы также заключили, что существует высокий риск предвзятости из-за набора, отсутствия скрининга на психиатрические расстройства, отсутствия четких диагностических критериев для хронической боли и отсутствия ослепления. «Единственные наши эмпирические доказательства недостатков рабочей памяти при хронической боли подвергаются высокому риску предвзятости, что оставляет нас открытыми для возможности, что такие недостатки действительно не существуют.» Они рекомендуют, чтобы в будущем исследования использовали последовательный набор, применяли признанные критерии для хронической боли, проводили скрининг контрольной группы на хроническую боль и обеих групп на психиатрические расстройства, ослепляли обоих оценщиков и пациентов и использовали большие выборки для получения более достоверных результатов.
Последствия для лечения
Как физиотерапевтам, нам важно понять изменения, происходящие при хронической боли, чтобы мы могли лучше обучать наших пациентов относительно их боли. Обучение пациентов в управлении болью обсуждает текущие исследования в области обучения пациентов с хронической болью и различных факторов, которые могут влиять на обучение пациентов.
Изменения в мозге, происходящие из-за хронической боли, связаны с пластичностью нервной системы и мозга. Именно эта основополагающая пластичность предполагает, что эти изменения могут быть восприимчивы к целенаправленному лечению. Мозели и Флор (2012) объединяют эти методы лечения в когнитивно-поведенческие, сенсорные и моторные стратегии.
Мозели и Флор (2012) утверждают, что цели когнитивно-поведенческого лечения для хронической боли заключаются в «увеличении здоровых поведений, связанных с работой, отдыхом и семьей; снижении медикаментозного лечения и изменении реакций значимых других людей с заботливых на отвлекающие или пренебрегающие.» Пациентам обучают стратегиям таким как отвлечение, медитация или релаксация и когнитивная переоценка наряду с планированием активности, чтобы предотвратить обострения. Их также обучают о боли и факторах, ведущих к хронической боли, а также факторах, которые ее модулируют. Исследования показывают, что эта терапия улучшает функциональные возможности и уменьшает боль, позволяя пациенту установить контроль над болью и сформировать поведения, которые ограничивают влияние боли на качество жизни.[11] Поведенческие подходы к управлению болью обсуждают когнитивно-поведенческое лечение в деталях.
Уонд и др. (2011) обнаружили, что существует возрастающее количество доказательств, что градуированная моторная имиджерия эффективна при лечении комплексного регионального болевого синдрома, и Мозели и Флор (2012) также поддерживают это. Все трое авторов также заключили, что сенсорные программы дискриминационного обучения были эффективны в снижении боли и увеличении функции у пациентов с фантомной болью в конечности.[12][11] Градуированная моторная имиджерия состоит из трех последовательных стадий, латеральности (распознавание левого и правого), воображаемых движений и зеркальной терапии. Цель этих градуированных прогрессий заключается в тренировки мозга для десенситизации, привыкания и развития функции. Более подробную информацию о градуированной моторной имиджерии можно найти здесь. Уонд и др. (2011) предупреждают о необходимости быть осторожными при обобщении этих данных на популяцию с хронической болью в пояснице, поскольку значительное количество исследований еще нужно провести в этой области, прежде чем можно будет дать твердые рекомендации по этому типу подхода к управлению.[12]
Ссылки
- ↑ Melzack R. Боль и нейроматрица в мозге. Journal of Dental Education 2001;65(12): 1378-1382
- ↑ 2.0 2.1 2.2 2.3 Lithwick A, Lev S, Binshtock A. Хронические болевые изменения коры головного мозга – «память боли»: возможная цель для лечения хронической боли. Pain Management 2013;3(1): 35-45
- ↑ Maihofner C, Handwerker HO, Birklein F. Функциональная визуализация аллодинии при синдроме сложной региональной боли. Neurology 2006; 66(5): 711-717.
- ↑ Flor H. Реорганизация коры и хроническая боль: последствия для реабилитации. Journal of Rehabilitative Medicine Suppl. 2003;41: 66-72
- ↑ Wand BM, Parkitny L, O’Connell NE, Luomajoki H, McAuley JH, Thacker M, Moseley L. Изменения коры при хронической боли в пояснице: текущее состояние и последствия для клинической практики. Manual Therapy 2011;16: 15-20
- ↑ Seminowicz DA, Wideman TH, Naso L, Hatami-Khoroushahi Z, Fallatah S, Ware MA, Jarzem P, Bushnell C, Shir Y, Ouellet JA. Эффективное лечение хронической боли в пояснице у людей обращает вспять аномалии анатомии и функции мозга. The Journal of Neuroscience 2011;31(20): 7540-7550
- ↑ Happy & Well. Lorimer Moseley "Тело в разуме - роль мозга при хронической боли" на Mind & Its Potential 2011. Доступно с: http://www.youtube.com/watch?v=RYoGXv22G3k [последний доступ 29/11/15]
- ↑ 8.0 8.1 Berryman C, Stanton T, Bowering KJ, Tabor A, McFarlane A, Moseley L. Доказательства нарушений рабочей памяти при хронической боли: систематический обзор. Pain 2013;154: 1181-1196
- ↑ 9.0 9.1 Walteros C, Sanchez-Navarro JP, Munoz MA, Martinez-Selva JM, Chialvo D and Montoya P. Измененное ассоциативное обучение и эмоциональное принятие решений при фибромиалгии. Journal of Psychosomatic Research 2011;70: 294-301.
- ↑ 10.0 10.1 Legrain V, Van Damme S, Eccleston C, Davis KD, Seminowicz DA and Crombez. Нейрокогнитивная модель внимания к боли: поведенческие и нейровизуализационные доказательства. Pain 2009;144: 230-232.
- ↑ 11.0 11.1 Moseley L and Flor H. Нацеливание на кортикальные представления в лечении хронической боли: обзор. Neurorehabilitation and Neural Repair 2012;26(6): 646-652.
- ↑ 12.0 12.1 Wand BM, Parkitny L, O’Connell NE, Luomajoki H, McAuley JH, Thacker M, Moseley L. Изменения коры при хронической боли в пояснице: текущее состояние и последствия для клинической практики. Manual Therapy 2011;16: 15-20
