Введение
Передняя крестообразная связка (ACL) — это ключевая структура в коленном суставе, так как она противостоит переднему смещению большеберцовой кости и ротационным нагрузкам. [1] Она является одной из наиболее часто повреждаемых структур при высоких нагрузках или спортивных мероприятиях. [2] ACL не заживает при разрыве, и хирургическая реконструкция является стандартным лечением в области спортивной медицины. [3] Такая реконструкция направлена на восстановление кинематики и стабильности поврежденного колена, чтобы предотвратить будущие дегенеративные изменения. [4] [5] Поэтому достаточное понимание сложной анатомии, функции и биомеханики ACL является критическим для раскрытия механизмов травмы, понимания последствий хронической недостаточности ACL и улучшения хирургической реконструкции.
Развитие ACL
Колено развивается из сосудистой мезенхимы бедренной и большеберцовой костей на четвертой неделе гестации между бластомой бедра и голени. [6] [7] К 9 неделе, крестообразные связки состоят из множества незрелых фибробластов с скудной цитоплазмой и веретенообразными ядрами. [8] После 20 недели оставшееся развитие заключается в значительном росте с небольшими изменениями в форме. На этих этапах уже различимы два основных пучка, но пучки казались более параллельными по сравнению с ориентацией пучков взрослого ACL. [9] Она окружена складкой синовиальной оболочки, напоминающей брыжейку, которая исходит от заднего капсульного аппарата коленного сустава. Таким образом, несмотря на то, что ACL располагается внутри капсулы, она остается экстра-синовиальной на всем своем протяжении. [10]
Раннее проявление ACL с двумя различными пучками в эмбриональном колене предполагает, что раннее развитие коленного сустава направляется ACL. Наличие крестообразных связок на этой ранней стадии развития может приводить к предположению, что они взаимодействуют с формированием бедренных мыщелков и площадки тибии. [5]
Грубая анатомия
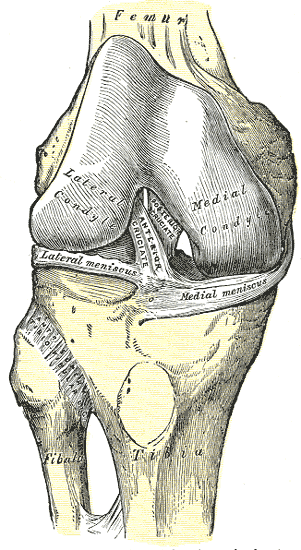
Бедренное прикрепление
Передняя крестообразная связка (ПКС) представляет собой ленточную структуру из плотной соединительной ткани. ПКС прикрепляется к ямке на задней поверхости медиальной части латерального мыщелка бедренной кости. [11] [7] Бедренное прикрепление имеет форму сегмента круга с прямой передней гранью и выпуклой задней гранью. Его длинная ось слегка наклонена вперед от вертикали, и задняя выпуклость параллельна заднему суставному краю латерального мыщелка бедра. [11] От своего бедренного прикрепления ПКС проходит кпереди, медиально и дистально к большеберцовой кости. Его длина колеблется от 22 до 41 мм (в среднем 32 мм), а ширина - от 7 до 12 мм. [12]
Большеберцовое прикрепление
ПКС прикрепляется к ямке перед и сбоку от передней большеберцовой ости. На этом месте прикрепления ПКС проходит под поперечной менисковой связкой, и некоторые фасцы ПКС могут сливаться с передним прикреплением латерального мениска. Иногда фасцы с задней поверхности большеберцового прикрепления ПКС могут распространяться и сливаться с задним прикреплением латерального мениска. Большеберцовое прикрепление ПКС несколько шире и сильнее, чем бедренное прикрепление. [11] Площадь поперечного сечения увеличивается от бедра к большеберцовой кости следующим образом: 34 мм2 проксимально, 33 мм2 средне-проксимально, 35 мм2 на уровне средней субстанции, 38 мм2 средне-дистально и 42 мм2 дистально. [13] Они также сообщили, что большеберцовое включение ПКС составляет примерно 120% от площадки бедренного включения. [14]
Пространственная ориентация
В литературе возникает путаница при категоризации фасцикулярной анатомии. Уэлш (1980) и Арноцки (1983) описали ПКС как единый широкий континуум фасций, с разными частями, тугими на протяжении всего диапазона движения. [15] [16] Однако функционально, Гиргис и др. разделили ПКС на две части: передне-медиальный пучок (ПМП) и задне-боковой пучок (ЗБП), [11] в то время как другие авторы разделили ПКС на три функциональных пучка (ПМП, промежуточный пучок и ЗБП). [12] [17] В недавнем исследовании с использованием МРТ и 3D визуализации были обнаружены три пучка в 22 коленях (92%) и два пучка в 2 коленях (8%) участников исследования[18]. Однако модель с двумя пучками была в целом принята как лучшая для понимания функции ПКС.
ПКС проходит кпереди, медиально и дистально через сустав, как она переходит от бедра к большеберцовой кости. При этом она слегка закручивается наружу (латерально). Это связано с ориентацией ее костных прикреплений. Ориентация бедренного прикрепления ПКС, по отношению к положению сустава (сгибание/разгибание), также отвечает за относительное натяжение связки на протяжении всего диапазона движения. [7]Прикрепление ПКС представляет собой скопление отдельных фасций, которые расширяются на широкую плоскую область. [11] Эти фасции были поделены на две группы:
| Передне-медиальный пучок (ПМП) | Задне-боковой пучок (ЗБП) | |
|---|---|---|
| Прикрепление | начало у проксимального аспекта бедренного прикрепления и вставка на передне-медиальный аспект большеберцового прикрепления | вставка на задне-боковой аспект большеберцового прикрепления. |
| Ориентация | В фронтальной плоскости ПМП имеет более вертикальную ориентацию (приблизительно 70° к оси коленного сустава) | ЗБП ориентирован более горизонтально (приблизительно 55° к оси коленного сустава)[7] . |
| ПМП умеренно расслаблен при разгибании колена и туг при сгибании. | ЗБП туг при разгибании колена и расслаблен при сгибании[11]. | |
| Функционально при сгибании | Функционально при разгибании |
Внутренняя ротация удлиняет ПКС немного больше, чем внешняя ротация, что заметнее всего на 30° сгибания. Кроме того, Марколф и др. сообщили, что ПКС действует как второстепенное ограничение для варус-валгусной ангуляции при полном разгибании. [19] Скручивание сопротивляется сочетанием капсулярного сдвига, наклонного действия связки, суставной поверхности и геометрии мениска, в то время как крестообразные играют только второстепенную роль. [1]
Хотя разделение на две группы дает общее представление о динамике ПКС на протяжении всего диапазона движения, это несколько упрощает, так как разные части ПКС тугие на протяжении всего диапазона движения. [16] Это имеет большое клиническое значение, так как в любом положении колена часть ПКС остается под напряжением и функциональной.
Недавно, Зантоп и др. предложили классификацию внутрисуставного разрыва ПКС с учетом его двух пучков. [20] Эта классификация состоит из буквенно-цифрового кода с буквами для расположения разрыва ПМП и цифрами для расположения разрыва ЗБП. Место разрыва бедренного ПМП классифицируется как 1, разрыв средней субстанции - как 2, а большеберцовый разрыв ПМП - как 3. Удлиненный функционально несостоятельный ПМП классифицируется как 4, а целый ПМП - как 5. Для ЗБП разрыв в месте начала бедра, средней субстанции или большеберцового вставки классифицируется как A, B и C соответственно. Удлиненные пучки PL классифицируются как D, а целый пучок PL - как E. Внутриоперационно оцениваемый рисунок разрыва ПМП и PL можно выразить с помощью этого буквенно-цифрового кода; например, 1A для бедренного разрыва ПМП и бедренного разрыва PL пучка. Валидность и надежность возможной классификации в настоящее время разрабатываются.
Микроанатомия
Сложная ультраструктурная организация, разная ориентация пучков в ПКС и обильная эластическая система делают её очень отличной от других связок и сухожилий. ПКС - это уникальная и сложная структура, способная выдерживать многоосевые напряжения и переменные растяжения. [22]
Микроскопически мы можем выделить три зоны в пределах ПКС:
- Проксимальная часть, которая менее плотная, обладает высокой клеточной плотностью, богата круглыми и овальными клетками, содержащими некоторые веретенообразные фибробласты, коллаген типа II и гликопротеины, такие как фибронектин и ламинин.
- Средняя часть, содержащая веретенообразные фибробласты, обладает высокой плотностью коллагеновых волокон, особой зоной хрящей и фиброхрящей (особенно в передней части, где связка соприкасается с передним ободом межмыщелковой выемки), эластических и окситалановых волокон. Окситалановые волокна выдерживают умеренные многослойные напряжения, в то время как эластические волокна поглощают повторяющийся максимальный стресс. Веретенообразные фибробласты преобладают в этой средней части, которая также называется веретенообразной зоной и располагается в средней части и проксимальной четверти связки.
- Дистальная часть, которая наиболее плотная, богата хондробластами и овальными фибробластами с низкой плотностью коллагеновых пучков. Фибробласты, расположенные по обе стороны от коллагеновых пучков, имеют округлую или овальную форму и напоминают клетки суставного хряща. В передней части ПКС, примерно на 5–10 мм проксимальнее места прикрепления к большеберцовой кости, слой плотной соединительной ткани окружает связку вместо синовиальной ткани. Эта область соответствует зоне, где связка ударяется о передний край межмыщелковой выемки бедренной кости при полном разгибании колена.
Феморальное происхождение и большеберцовое прикрепление имеют структуру хондрального апофизарного энтеза, состоящего из четырех слоев. Первый слой состоит из связочных волокон. Фибро-хрящевые клетки, выстроенные среди коллагеновых пучков, можно найти во втором слое, описываемом как зона неминерализованного хряща, в то время как третий слой - зона минерализованного хряща. Фиброхрящ минерализуется и внедряется в пластину подхрящевой кости, которая является четвертым слоем.[23] Благодаря этой специфической анатомии мест прикрепления ПКС имеет переходную зону от жесткой кости к связочной ткани, что позволяет осуществить постепенное изменение жесткости и может предотвращать концентрацию напряжения в месте прикрепления [15][24][8]. Основной коллаген в ПКС - это коллаген типа I, рыхлая соединительная ткань состоит из коллагена типа III. [25]
Интересно, что одно анатомическое исследование выявило различия в структуре переднемедиальных и заднелатеральных пучков. [25] В передней части переднемедиального пучка типичная морфология клеток отличается от типичной структуры остальной части ПКС. В этой области клетки не выглядят вытянутыми. При полном разгибании эта часть ПКС находится в прямом контакте с межмыщелковой выемкой. [25] Гистологические срезы этой области показывают типичные тендоциты и клетки, подобные хондроцитам. Эти хондроидные клетки даже продуцируют небольшое количество специфического для хряща коллагена типа II. Из-за прямого контакта хряща и связки появление хондроцитов можно объяснить как функциональную адаптацию связки к компрессионному напряжению, которое возникает из-за физиологической компрессии между ПКС и передним ободом межмыщелковой выемки. [25] Используя количественное поляризованное световое изображение (QPLI) Скелли и коллеги [26] сообщили о большей общей жесткости и прочности переднемедиального пучка и более сильной ориентации коллагеновых волокон при нагрузке.
Организация фибрилл ПКС
Организация фибрилл ПКС - это комбинация геликоидальных и планарных, параллельных или спиральных, нелинейных сетей. Централизованно расположенные фасции в ПКС либо прямые, либо волнистые в виде планарной волны, в то время как расположенные на периферии организованы в геликоидальной волновой форме. Назначение волновой и нелинейной структуры фибрилл интерпретируется как «волнистость» и «рекрутирование» соответственно. [27] Волнистость представляет собой регулярный синусоидальный узор в матрице. Этот образ, подобный гармошке, в матрице предоставляет своего рода "буфер", в котором может происходить небольшое продольное удлинение без разрушения волокон. Он также предоставляет механизм для контроля напряжения и выступает в качестве "амортизатора" вдоль длины ткани. [28] Таким образом, при растяжении в первую очередь выпрямляется волнистость фибрилл под малыми нагрузками, после чего для их удлинения требуются большие нагрузки. Как результат, всё большее число фибрилл становится несущими при увеличении нагрузки («рекрутирование»), и наблюдается постепенное увеличение жесткости ткани, результирующее в нелинейной напряжении-удлинении кривой. Это явление позволяет ПКС быстро предоставлять дополнительную защиту суставу. [28]
Недавно Ли и др. выяснили, что эстроген напрямую регулирует структуру и функцию связок путем изменения синтеза типов I и III. [29] [30] Действительно, эстроген стимулирует синтез коллагена типов I и III на уровне мРНК, в то время как приложение механической силы снижает экспрессию генов коллагена типов I и III при всех протестированных уровнях эстрогена. [29]
Эффект механической разгрузки на гистологические изменения
Чен и др. представили модель человеческой ПКС для оценки эффектов механической разгрузки на гистологические изменения тканей связок с течением времени. [31] Тестируемые параметры включали плотность фибробластов, амплитуду волнистости и форму ядра волнистости. Авторы наблюдали последовательные изменения: плотность фибробластов значительно увеличивалась в течение 5-6 недель разгрузки. К 7-8 неделе амплитуда волнистости значительно уменьшалась, сопровождаемая формированием нерегулярных волоконных узоров и фрагментов. Это сопровождалось изменением длины волны волнистости и формы ядра с веретенообразной на овальную в течение 9-14 недель. Согласно литературе, физическая нагрузка оказывает важное стимулирующее действие для поддержания нормальной структуры и функции тканей связок. Генальная экспрессия коллагенов типов I и III также стимулируется механическим растяжением в клетках ПКС посредством активации трансформирующего фактора роста (TGF)-b1. [30] Таким образом, авторы подчеркнули важный концепт ранней имплементации механических сил в программах реабилитации для пациентов с травмированными связками для предотвращения негативных эффектов вследствие механической разгрузки.
Биомеханика
Пучки волокон ПКС не функционируют как простая полоса волокон с постоянным натяжением; на самом деле, они демонстрируют различную картину натяжения во всем диапазоне движения. Разделение ПКС на два функциональных пучка, переднемедиальный (ПМП) и заднелатеральный (ЗЛП), кажется упрощением, но описание двух пучков волокон ПКС широко принято в качестве основы для понимания функции ПКС. Терминология пучков была выбрана в соответствии с их вставкой в тибию: волокна ПМП начинаются в самой проксимальной части места происхождения ПМП на бедре и вставляются в переднемедиальную вставку на тибии.[11] [24] [8] [11] Сакайне и др. показали, что при нагрузке на переднее смещение тибии 134 Н силы, воспринимаемые ЗЛП, выше при меньших углах сгибания по сравнению с ПМП. [32] Однако было показано, что ПМП принимает на себя большую часть приложенной внешней силы при больших углах сгибания. [32] Используя стрейн-гейдж из жидкого металла, Бах и др. сообщили о более высоком натяжении в ЗЛП, чем в ПМП, при сгибании колена ниже 200. [3] Биомеханическое исследование, проведенное на человеческих кадаврах, показало незначительное увеличение переднего смещения тибии после частичного разрыва ПМ или ЗЛ пучков [33]. Взаимная функция между двумя пучками остается неясной в литературе[34].
Недавнее исследование проведено с использованием робота/универсального датчика момента силы и подчеркнуло важность ЗЛП. [35] В этом исследовании было показано, что внутренняя сила ЗЛП в ответ на переднюю нагрузку 134 Н достигала максимума при полной разгибке и уменьшалась с увеличением сгибания. [35] Эти авторы также продемонстрировали, что ЗЛП играет значительную роль в стабилизации колена против комбинированной вращательной нагрузки. [35] Недавнее in vivo исследование с использованием радиографического стереофотограмметрического анализа (RSA) оценило кинематику коленного сустава после реконструкции ПКС (техника с одним пучком) и не пострадавших (контралатеральных) коленных суставов у шести субъектов во время бега вниз. [36] Авторы пришли к выводу, что реконструкция ПКС с одним пучком не восстановила нормальную вращательную кинематику колена во время динамической нагрузки. В заключение, кажется, существует некоторое согласие в пользу гипотезы, что ЗЛП более ограничивает ротацию тибии, чем ПМП.
После разрыва ПКС ось вращения коленного сустава изменяется, что нарушает внутреннюю вращательную стабильность[37]. В результате движение в заднелатеральном компоненте увеличивается до 413% при 15° сгибания колена[38]. Люди с разрывом ПКС, как правило, жалуются на нестабильность колена или его подкашивание. [39]
Структурные и механические свойства
Структурные свойства можно описать как свойства связки или сухожилия вместе с местом его вставки и фиксационными устройствами [40], в то время как механические свойства можно определить как свойства самой связки или трансплантата без учета мест вставки.[28] При испытании на растяжение комплекса бедро-ПКС-тибия (FATC) кривая нагрузки-удлинения представляет собой структурные свойства FATC (рис. 1A). Форма кривой зависит от свойств субстанции связки, геометрии комплекса и места вставки связки в кость. Важные структурные свойства включают линейную жесткость, предельную нагрузку, предельную деформацию и энергию, поглощенную при разрушении (площадь под кривой). [41]


Хотя структурные свойства предоставляют ценную информацию о FATC, они не могут рассказать нам конкретно о материале, составляющем связку. "Механические свойства" субстанции связки можно вывести из кривой напряжения-деформации (рис. 1B). Из значений кривой напряжения-деформации можно также определить модуль, предельное напряжение и плотность энергии. [40]
Показано, что структурные и механические свойства естественного ПКС уменьшаются с возрастом. [40] Средняя предельная нагрузка FATC у образцов в возрасте 22–35 лет составляет 2,160 (± 157) N. [40] Жесткость реконструкции ПКС или естественного FATC можно определить в тестах на разрушение в линейном регионе кривой нагрузки-удлинения. Для образцов в возрасте 22–35 лет жесткость FATC составила 242 (± 28) N/мм. [40] Энергию, поглощенную при разрушении, можно рассчитать по площади под кривой, и у образцов в возрасте 22–35 лет было установлено, что энергия, поглощенная при разрушении, составляет 11,6 (± 1,7) Нм. [40]
Сложная геометрическая конфигурация и различная длина пучков волокон ПКС затруднили попытки рассчитать напряжение и деформацию. Батлер и др. разделили человеческую связку ПКС на части и тестировали отдельные блоки на средний модуль и предельную прочность на растяжение. [42] Средний модуль и предельная прочность на растяжение составили 278 и 35 МПа соответственно. Связки достигали своего предельного напряжения при -15% деформации. В более позднем исследовании Батлер и др. обнаружили, что ПМП продемонстрировал больший модуль, предельную прочность на растяжение и плотность энергии деформации, чем задняя часть. [43]
Свойства трансплантатов
Два наиболее часто используемых трансплантата — это трансплантаты из кости-сухожилия-кости (BPTB) и трансплантаты из подколенных сухожилий в качестве аутологичных трансплантатов сухожилий. Цель выбора трансплантата должна заключаться в соответствии кривой нагрузки-удлинения для трансплантатов ПКС с кривой, создаваемой человеческим FATC. Структурные свойства трансплантата шириной 10 мм из пателлярного сухожилия были признаны сопоставимыми с натянутым ПКС со средней предельно прочной нагрузкой 1,784 (± 580) N и средней жесткостью 210 N/мм. [44] Биомеханический анализ трансплантата из четырех подколенных сухожилий выявил среднюю предельную нагрузку и жесткость 2,422 (± 538) N и 238 N/мм соответственно. [44] Однако эти исследования проводились в начальной точке времени, и исследования на животных показали, что структурные свойства реконструкций ПКС уменьшаются из-за заживления и ремоделирования трансплантата. Вейлер и др. показали на модели овцы, что прочность на растяжение мягкотканевого трансплантата, зафиксированного фиксацией с помощью интерференционного винта, снижается до 6,9% от уровня в начальной точке времени, и может потребоваться до 12 недель, чтобы вновь достичь уровня прочности в момент реконструкции (начальная точка времени). [45]
Эффекты стабилизации мышц
Мышцы, пересекающие коленный сустав, играют важную роль в поддержании нормальной кинематики неповрежденного колена. Активность мышц может вызвать значительные изменения в деформациях и силах, испытываемых передней крестообразной связкой (ПКС). [7] Маркоф и др. обнаружили, что пассивное разгибание колена вызывает силы в ПКС только в последние 100° разгибания, в то время как силы в 200 Н на сухожилие квадрицепса вызывают увеличение сил в ПКС на всех углах сгибания коленного сустава. [19] Было продемонстрировано, что силы мышцы квадрицепса вызывают увеличение переднего смещения большеберцовой кости, в то время как силы подколенной мышцы оказывают противоположный эффект. При сочетанных силах квадрицепса и подколенной мышцы напряжения в AM-сегменте не различаются от ненагруженного колена во всех углах сгибания колена. [46] На основании уравнений баланса сил и геометрических данных из рентгенограмм здоровых колен, Ясуда и Сасаки предложили, что мышцы квадрицепса и подколенной мышцы могут быть активированы одновременно с коленом почти полностью разогнутым, не вызывая значительной передней силы.[47]
Было установлено, что при ходьбе, подъеме и спуске по ступеням на ПКС действуют самые высокие силы сдвига по сравнению с другими видами деятельности, такими как сидение, вставание и сгибание колена[48].
На практике разгибанию следует уделять приоритетное внимание, изометрические упражнения на сокращение для квадрицепса и подколенной мышцы безопасно применять под любыми углами. Кроме того, полный активный и пассивный диапазон движений можно выполнять после реконструкции ПКС.[49]
В последнее время Заффанини и др. провели качественную и количественную гистологическую оценку процесса неолигаментизации аутологичного костно-надколенного сухожилия (БТПБ), используемого в качестве ПКС, в разные сроки наблюдения с помощью трансмиссионной электронной микроскопии (ТЭМ).[50] Их результаты показали, что до 24 месяцев наблюдения наблюдаются прогрессивные ультраструктурные изменения в сторону нормальной ПКС. В более поздние сроки после операции (48 и 120 месяцев) дальнейших изменений не наблюдалось, и ультраструктура продемонстрировала значительное уменьшение крупных фибрилл, что было типично для контрольного надколенного сухожилия, и значительное увеличение малых фибрилл. Казалось, что ультраструктура сочетает фибриллы из двух разных морфологических единиц. Использованный в качестве ПКС трансплантат БТПБ претерпел процесс трансформации в течение двух лет. После этого периода трансформация прекратилась, и на протяжении десяти лет не достигла ультраструктурного вида нормальной ПКС. Однако с архитектурной точки зрения трансплантат медленно трансформировался в структуру, подобную ПКС, с учетом различных механических нагрузок, которым подвергается связка. [50] В настоящее время проводится аналогичное исследование с аутологичным трансплантатом подколенной мышцы.
Кроме того, Окахаши и др. недавно оценили, могут ли сухожилия подколенной мышцы восстанавливаться после их забора для реконструкции передней крестообразной связки (ПКС) и может ли восстанавливаемая ткань быть гистологически охарактеризована как сухожильная. В их исследовании восстановление сухожилия было обнаружено макроскопически у 9 из 11 пациентов. Гистологически и иммунохимически регенерированные сухожилия напоминали нормальные. Результаты исследования показывают, что сухожилия подколенной мышцы могут регенерировать после их забора для реконструкции ПКС. [51] Однако использование трансплантатов подколенной мышцы для реконструкции ПКС может привести к различным гистологическим паттернам заживления сухожилия-кость. Микродвижение трансплантата подколенной мышцы внутри пробуренного канала может играть роль в заживлении сухожилия-кость. [52]
Исследование, которое изучало молекулярные характеристики разгибателей колена после реконструкции ПКС, обнаружило снижение процента медленных волокон, уменьшение плотности митохондриальных волокон и отношение капилляров к волокнам, особенно в латеральной широкой мышце бедра, в течение до 5 лет после операции[53].
Литература
- ↑ 1.0 1.1 Matsumoto H, Suda Y, Otani T, Niki Y, Seedhom BB, Fujikawa K. Роли передней крестообразной связки и медиальной коллатеральной связки в предотвращении вальгусной нестабильности. Journal of orthopaedic science. 2001 Jan 1;6(1):28-32.
- ↑ Van den Bogert AJ, McLean SG. Травмы передней крестообразной связки: знаем ли мы механизмы?. Journal of Orthopaedic and Sports Physical Therapy. 2007;37(2):A8.
- ↑ 3.0 3.1 Bach BR, Levy ME, Bojchuk J, Tradonsky S, Bush-Joseph CA, Khan NH. Эндоскопическая реконструкция передней крестообразной связки через один разрез с использованием аутотрансплантата из пателлярного сухожилия. The American journal of sports medicine. 1998 Jan;26(1):30-40.
- ↑ Freedman KB, D'Amato MJ, Nedeff DD, Kaz A, Bach BR. Артроскопическая реконструкция передней крестообразной связки: метаанализ, сравнивающий аутотрансплантаты из пателлярного сухожилия и сухожилия подколенной мышцы. The American journal of sports medicine. 2003 Jan;31(1):2-11.
- ↑ 5.0 5.1 Lohmander LS, Östenberg A, Englund M, Roos H. Высокая частота гонартроза, боли и функциональных ограничений у футболисток через двенадцать лет после травмы передней крестообразной связки.
- ↑ Arthritis & Rheumatism: Официальный журнал Американской коллегии ревматологии. 2004 Окт;50(10):3145-52.
- ↑ Petersen W, Laprell H. Внедрение аутологичных сухожильных трансплантатов в кость: гистологическое и иммунохимическое исследование трансплантатов из подколенного и надколенного сухожилия. Хирургия коленного сустава, спортивная травматология, артроскопия. 2000 Янв 1;8(1):26-31.
- ↑ 7.0 7.1 7.2 7.3 7.4 Zantop T, Petersen W, Sekiya JK, Musahl V, Fu FH. Анатомия и функция передней крестообразной связки в связи с анатомической реконструкцией. Хирургия коленного сустава, спортивная травматология, артроскопия. 2006 Окт;14(10):982-92.
- ↑ 8.0 8.1 8.2 Petersen W, Tillmann B. Анатомия и функция передней крестообразной связки. Der Orthopade. 2002 Авг 1;31(8):710-8.
- ↑ Tena-Arregui J, Barrio-Asensio C, Viejo-Tirado F, Puerta-Fonollá J, Murillo-González J. Артроскопическое исследование коленного сустава у плодов. Артроскопия: Журнал артроскопии и связанных хирургий. 2003 Окт 1;19(8):862-8.
- ↑ Ellison AE, Berg EE. Эмбриология, анатомия и функция передней крестообразной связки. Ортопедические клиники Северной Америки. 1985 Янв 1;16(1):3-14.
- ↑ 11.0 11.1 11.2 11.3 11.4 11.5 11.6 11.7 Girgis FG, Marshall JL, Monajem AR. Крестовидные связки коленного сустава. Анатомический, функциональный и экспериментальный анализ. Clinical orthopaedics and related research. 1975 Jan 1(106):216-31.
- ↑ 12.0 12.1 Amis AA, Dawkins GP. Функциональная анатомия передней крестовидной связки. Действия пучков волокон, связанные с заменой и травмами связок. The Journal of bone and joint surgery. British volume. 1991 Mar;73(2):260-7.
- ↑ Harner CD, Livesay GA, Kashiwaguchi S, Fujie H, Choi NY, Woo SY. Сравнительное исследование размеров и формы передних и задних крестовидных связок человека. Journal of orthopaedic research. 1995 May;13(3):429-34.
- ↑ Harner CD, Baek GH, Vogrin TM, Carlin GJ, Kashiwaguchi S, Woo SL. Количественный анализ мест крепления крестовидных связок человека. Arthroscopy: The Journal of Arthroscopic & Related Surgery. 1999 Oct 1;15(7):741-9.
- ↑ 15.0 15.1 Arnoczky SP. Анатомия передней крестовидной связки.
- ↑ 16.0 16.1 WELSH RP. Структура и функция коленного сустава. Clinical Orthopaedics and Related Research (1976-2007). 1980 Mar 1;147:7-14.
- ↑ Hollis JM, Takai S, Adams DJ, Horibe S, Woo SY. Эффекты движения колена и внешней нагрузки на длину передней крестообразной связки (ACL): кинематическое исследование.
- ↑ Otsubo H, Akatsuka Y, Takashima H, Suzuki T, Suzuki D, Kamiya T, Ikeda Y, Matsumura T, Yamashita T, Shino K. МРТ изображение и трехмерная визуализация трех пучков передней крестообразной связки. Clinical Anatomy. 2017 Mar;30(2):276-83.
- ↑ 19.0 19.1 Markolf KL, Mensch JS, Amstutz HC. Жесткость и податливость колена - вклад поддерживающих структур. Количественное in vitro исследование. JBJS. 1976 Jul 1;58(5):583-94.
- ↑ Zantop T, Brucker PU, Vidal A, Zelle BA, Fu FH. Внутрисуставной тип разрыва передней крестообразной связки. Clinical Orthopaedics and Related Research (1976-2007). 2007 Jan 1;454:48-53.
- ↑
- ↑ ReadySetMed. Что такое передняя крестообразная связка и как она работает? - Серия о передней крестообразной связке. Доступно по ссылке: https://www.youtube.com/watch?v=-3ZYNV0Py5E [последний доступ 12/3/2022]
- ↑ Zaffagnini S, Golanò P, Farinas O, Depasquale V, Strocchi R, Cortecchia S, Marcacci M, Visani A. Сосудистость и нейрорецепторы гусятной лапки: анатомическое исследование. Клиническая анатомия. 2003 Янв;16(1):19-24.
- ↑ Fu FH, Bennett CH, Lattermann C, Ma CB. Текущие тренды в реконструкции передней крестообразной связки. Американский журнал спортивной медицины. 1999 Нояб;27(6):821-30.
- ↑ 24.0 24.1 Dienst M, Burks RT, Greis PE. Анатомия и биомеханика передней крестообразной связки. Ортопедические клиники. 2002 Окт 1;33(4):605-20.
- ↑ 25.0 25.1 25.2 25.3 Petersen W, Tillmann B. Строение и васкуляризация крестообразных связок коленного сустава человека. Анатомия и эмбриология. 1999 Июль 1;200(3):325-34.
- ↑ Skelley NW, Lake SP, Brophy RH. Микроструктурные свойства передней крестообразной связки. Анналы сустава. 2017 Май 23;2(5).
- Smith BA, Livesay GA, Woo SL. Биология и биомеханика передней крестообразной связки. Clinics in sports medicine. 1993 Oct 1;12(4):637-70.
- ↑ 28.0 28.1 28.2 Woo SL, Gomez MA, Seguchi Y, Endo CM, Akeson WH. Измерение механических свойств связочного вещества из костно-связочно-костной подготовки. Journal of orthopaedic research. 1983;1(1):22-9.
- ↑ 29.0 29.1 Kim SG, Akaike T, Sasagawa T, Atomi Y, Kurosawa H. Генная экспрессия коллагена I и III типа при механическом растяжении клеток передней крестообразной связки. Cell structure and function. 2002;27(3):139-44.
- ↑ 30.0 30.1 Lee CY, Smith CL, Zhang X, Hsu HC, Wang DY, Luo ZP. Тянущие силы уменьшают стимулированный эстрогеном синтез коллагена в ПКС. Biochemical and biophysical research communications. 2004 May 14;317(4):1221-5.
- ↑ Chen CH, Liu X, Yeh ML, Huang MH, Zhai Q, Lowe WR, Lintner DM, Luo ZP. Патологические изменения человеческой связки после полного механического разгрузки. American journal of physical medicine & rehabilitation. 2007 Apr 1;86(4):282-9.
- ↑ 32.0 32.1Sakane M, Fox RJ, Glen SL, Livesay A, Li G, Fu FH. Силы in situ в передней крестообразной связке и ее пучках в ответ на передние нагрузки на большеберцовую кость. Журнал ортопедических исследований. 1997 Мар;15(2):285-93.
- ↑ Kondo E, Merican AM, Yasuda K, Amis AA. Биомеханический анализ нестабильности колена при изолированной недостаточности антеромедиального или постеролатерального пучка передней крестообразной связки. Arthroscopy: Журнал артроскопической & свзанной хирургии. 2014 Мар 1;30(3):335-43.
- ↑ Domnick C, Raschke MJ, Herbort M. Биомеханика передней крестообразной связки: физиология, разрыв и методы реконструкции. Мировой журнал ортопедии. 2016 Фев 18;7(2):82.
- ↑ 35.0 35.1 35.2 Gabriel MT, Wong EK, Woo SL, Yagi M, Debski RE. Распределение сил in situ в передней крестообразной связке в ответ на ротационные нагрузки. Журнал ортопедических исследований. 2004 Янв;22(1):85-9.
- ↑ Tashman S, Collon D, Anderson K, Kolowich P, Anderst W. Ненормальное ротаторное движение колена во время бега после реконструкции передней крестообразной связки. Американский журнал спортивной медицины. 2004 Июн;32(4):975-83.
- ↑ Amis AA, Bull AM, Lie DT. Биомеханика ротационной нестабильности и анатомической реконструкции передней крестообразной связки. Оперативные техники в ортопедии. 2005 Jan 1;15(1):29-35.
- ↑ Kanamori A, Sakane M, Zeminski J, Rudy TW, Woo SL. In-situ force in the medial and lateral structures of intact and ACL-deficient knees. Journal of orthopaedic science. 2000 Nov 1;5(6):567-71.
- ↑ Beard DJ, Davies L, Cook JA, Stokes J, Leal J, Fletcher H, Abram S, Chegwin K, Greshon A, Jackson W, Bottomley N. Реабилитация против хирургической реконструкции при неострой травме передней крестообразной связки (ACL SNNAP): прагматическое рандомизированное контролируемое испытание. The Lancet. 2022 Aug 20;400(10352):605-15.
- ↑ 40.0 40.1 40.2 40.3 40.4 40.5 Woo SL, Hollis JM, Adams DJ, Lyon RM, Takai S. Тензильные свойства комплекса бедренная кость — передняя крестообразная связка — большеберцовая кость человека: влияние возраста и ориентации образца. The American journal of sports medicine. 1991 May;19(3):217-25.
- ↑ Takeda Y, Xerogeanes JW, Livesay GA, Fu FH, Woo SL. Биомеханическая функция передней крестообразной связки человека. Arthroscopy: The Journal of Arthroscopic & Related Surgery. 1994 Apr 1;10(2):140-7.
- ↑ Butler DL, Kay MD, Stouffer DC. Сравнение механических свойств фасикулярно-костных единиц человеческого надколенной сухожилия и связок коленного сустава. Journal of biomechanics. 1986 Jan 1;19(6):425-32.
- ↑ Butler DL, Guan Y, Kay MD, Cummings JF, Feder SM, Levy MS. Зависимые от местоположения вариации механических свойств передней крестообразной связки. Journal of biomechanics. 1992 May 1;25(5):511-8.
- ↑ 44.0 44.1 Wilson TW, Zafuta MP, Zobitz M. Биомеханический анализ сопоставленных трансплантатов из кости-надколенной сухожилия-кости и двойной петли сухожилия полуперепончатой мышцы и сухожилия тонкой мышцы. The American journal of sports medicine. 1999 Mar;27(2):202-7.
- ↑ Weiler A, Hoffmann RF, Bail HJ, Rehm O, Südkamp NP. Заживление сухожилия в костном туннеле. Часть II: Гистологический анализ после биодеградируемой интерференционной фиксации в модели реконструкции передней крестообразной связки у овец. Arthroscopy: the journal of arthroscopic & related surgery. 2002 Feb 1;18(2):124-35.
- ↑ Draganich LF, Vahey JW. Исследование в условиях in vitro натяжения передней крестообразной связки, вызванного силами квадрицепса и подколенных сухожилий. Journal of orthopaedic research. 1990 Jan;8(1):57-63.
- ↑ Yasuda K, Sasaki T. Упражнения после реконструкции передней крестообразной связки. Сила, действующая на большеберцовую кость при различных изометрических сокращениях квадрицепса или подколенных сухожилий. Clinical orthopaedics and related research. 1987 Jul 1(220):275-83.
- ↑ Marieswaran M, Jain I, Garg B, Sharma V, Kalyanasundaram D. Обзор биомеханики передней крестообразной связки и материалов для реконструкции. Applied bionics and biomechanics. 2018 May 13;2018.
- ↑ O'Brien L. Реабилитация ПКС - Вводный курс. Plus.
- ↑ 50.0 50.1 Zaffagnini S, De Pasquale V, Reggiani LM, Russo A, Agati P, Bacchelli B, Marcacci M. Процесс неолигаментизации BTPB, использованного для трансплантата ПКС: гистологическая оценка от 6 месяцев до 10 лет. The Knee. 2007 Mar 1;14(2):87-93.
- ↑ Okahashi K, Sugimoto K, Iwai M, Oshima M, Samma M, Fujisawa Y, Takakura Y. Регенерация подколенных сухожилий после взятия для артроскопической реконструкции передней крестообразной связки: гистологическое исследование у 11 пациентов. Knee Surgery, Sports Traumatology, Arthroscopy. 2006 Jun 1;14(6):542-5.
- ↑ Nebelung W, Becker R, Urbach D, Röpke M, Roessner A. Гистологические находки заживления сухожилия-кости после реконструкции передней крестообразной связки сухожильными трансплантатами. Archives of orthopaedic and trauma surgery. 2003 May 1;123(4):158-63.
- ↑ Flück M, Viecelli C, Bapst AM, Kasper S, Valdivieso P, Franchi MV, Ruoss S, Lüthi JM, Bühler M, Claassen H, Hoppeler H. Пластичность мышц разгибателей колена на протяжении 5-летнего процесса реабилитации после открытой операции на колене. Frontiers in physiology. 2018 Sep 25;9:1343.
